Bilangan oksidasi (biloks) merupakan konsep fundamental dalam kimia yang digunakan untuk menentukan status oksidasi suatu unsur dalam senyawa atau ion. Pemahaman mengenai biloks sangat penting, terutama dalam reaksi redoks (reduksi dan oksidasi) yang mendominasi banyak proses kimia, baik dalam laboratorium maupun di alam. Artikel ini akan membahas secara mendalam aturan penentuan bilangan oksidasi dan aplikasinya.
Apa Itu Bilangan Oksidasi?
Bilangan oksidasi adalah angka yang menunjukkan jumlah elektron yang telah hilang atau diperoleh oleh suatu atom dalam senyawa kimia. Angka ini digunakan untuk melacak pergerakan elektron selama reaksi kimia, khususnya dalam reaksi redoks.
- Oksidasi: Proses pelepasan elektron yang meningkatkan bilangan oksidasi.
- Reduksi: Proses penambahan elektron yang menurunkan bilangan oksidasi.
Dengan biloks, kita dapat menentukan unsur mana yang teroksidasi atau tereduksi, serta memahami bagaimana reaksi redoks terjadi.
Aturan Penentuan Bilangan Oksidasi
Untuk menentukan bilangan oksidasi suatu unsur dalam senyawa atau ion, beberapa aturan harus diikuti secara sistematis. Berikut ini adalah aturan-aturan utama:
1. Bilangan Oksidasi Unsur Bebas
Setiap unsur dalam bentuk bebas (tidak berikatan dengan unsur lain) memiliki bilangan oksidasi nol (0).
Contoh:

2. Bilangan Oksidasi Ion Monoatomik
Untuk ion monoatomik, bilangan oksidasi sama dengan muatan ion tersebut.
Contoh:
- Ion natrium (Na+): Biloks = +1
- Ion klorida (Cl−): Biloks = -1
- Ion magnesium (Mg2+): Biloks = +2
3. Bilangan Oksidasi Hidrogen
- Dalam kebanyakan senyawa, hidrogen memiliki biloks +1.
- Namun, dalam senyawa hidrida logam (seperti NaH, CaH2), hidrogen memiliki biloks -1.
Contoh:
- H2 O: Hidrogen = +1
- NaH: Hidrogen = -1
4. Bilangan Oksidasi Oksigen
- Oksigen biasanya memiliki bilangan oksidasi -2.
- Dalam peroksida (seperti H2O2), oksigen memiliki biloks -1.
- Dalam senyawa dengan fluor (seperti OF2), oksigen memiliki biloks +2 karena fluor lebih elektronegatif.
Contoh:
- CO2: Oksigen = -2
- H2O2: Oksigen = -1
- OF2: Oksigen = +2
Baca juga: 4 Sifat Keperiodikan Unsur Lengkap Beserta Penjelasan
5. Bilangan Oksidasi Unsur Logam
- Logam dalam golongan IA selalu memiliki bilangan oksidasi +1 (contoh: Na, K).
- Logam dalam golongan IIA selalu memiliki bilangan oksidasi +2 (contoh: Mg, Ca).
- Logam transisi memiliki bilangan oksidasi yang bervariasi tergantung pada senyawa.
Contoh:
- NaCl: Natrium = +1
- MgCl2: Magnesium = +2
6. Jumlah Total Bilangan Oksidasi dalam Suatu Senyawa
Jumlah total bilangan oksidasi semua atom dalam suatu molekul netral harus nol (0).
Contoh:
- H2O:
Hidrogen = +1 (2 atom × +1 = +2)
Oksigen = -2
Total = +2 – 2 = 0 - NH3:
Nitrogen = -3
Hidrogen = +1 (3 atom × +1 = +3)
Total = -3 + 3 = 0
7. Jumlah Total Bilangan Oksidasi dalam Ion Poliatomik
Jumlah total bilangan oksidasi dalam ion poliatomik harus sama dengan muatan ion tersebut.
Contoh:
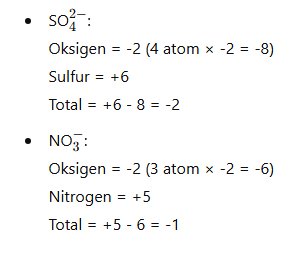
8. Unsur dengan Elektronegativitas Tinggi
Unsur dengan elektronegativitas lebih tinggi biasanya memiliki bilangan oksidasi negatif.
Contoh:
- Dalam HCl, klorin lebih elektronegatif, sehingga klorin = -1 dan hidrogen = +1.
Baca juga: Sifat Keperiodikan Unsur Afinitas Elektron Beserta Grafik
Penerapan Bilangan Oksidasi
Bilangan oksidasi digunakan dalam berbagai aspek kimia, seperti:
1. Menulis dan Menyelesaikan Persamaan Redoks
Dalam reaksi redoks, bilangan oksidasi digunakan untuk menentukan unsur mana yang teroksidasi dan mana yang tereduksi.
Contoh:
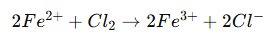
- Fe: Biloks berubah dari +2 menjadi +3 (oksidasi).
- Cl: Biloks berubah dari 0 menjadi -1 (reduksi).
2. Menentukan Sifat Asam-Basa Suatu Senyawa
Beberapa senyawa dapat bertindak sebagai asam atau basa tergantung pada bilangan oksidasi unsur pusat.
Contoh:
- Asam sulfat (H2SO4): Sulfur = +6 (asam kuat).
- Asam sulfur (H2SO3): Sulfur = +4 (asam lemah).
3. Prediksi Stabilitas Senyawa
Bilangan oksidasi juga digunakan untuk memprediksi stabilitas senyawa tertentu. Sebagai contoh, senyawa dengan bilangan oksidasi ekstrem (terlalu tinggi atau rendah) cenderung kurang stabil.
Baca juga: Larutan Kimia berdasarkan Konsentrasi dan Kejenuhan
Memahami aturan penentuan bilangan oksidasi adalah kunci untuk mendalami kimia, terutama dalam memahami reaksi redoks. Dengan menerapkan aturan-aturan ini secara sistematis, kita dapat menentukan bilangan oksidasi dengan akurat, menyusun persamaan reaksi dengan benar, dan menganalisis proses kimia yang kompleks.
Pengetahuan ini tidak hanya bermanfaat dalam pendidikan kimia, tetapi juga dalam aplikasi nyata seperti pengolahan logam, pengolahan air limbah, dan pengembangan teknologi energi bersih.
Semoga artikel ini membantu Anda memahami bilangan oksidasi dengan lebih baik dan memberikan wawasan yang berguna untuk studi kimia Anda!