Logam alkali adalah elemen yang terdapat dalam golongan pertama dari tabel periodik. Elemen-elemen ini meliputi litium (Li), natrium (Na), kalium (K), rubidium (Rb), sesium (Cs), dan fransium (Fr). Mereka dikenal karena sifat-sifat khas yang unik dibandingkan dengan logam-logam lainnya. Dalam artikel ini, kita akan mengulas berbagai sifat fisika logam alkali serta relevansinya dalam konteks studi fisika.
1. Letak dalam Tabel Periodik dan Konfigurasi Elektron
Logam alkali berada di golongan pertama dari tabel periodik, yang berarti mereka memiliki satu elektron valensi di kulit terluar. Konfigurasi elektronnya secara umum dapat ditulis sebagai [X]ns1, di mana X adalah inti yang terisi penuh dan nnn merupakan nomor periode atau nomor kulit.
Elektron valensi yang tunggal ini sangat mudah dilepaskan, sehingga membuat logam alkali sangat reaktif secara kimia. Dari segi fisika, konfigurasi elektron ini berperan dalam banyak sifat-sifat yang mereka miliki, seperti konduktivitas listrik dan panas.
2. Massa Jenis yang Rendah
Salah satu sifat fisika menarik dari logam alkali adalah massa jenisnya yang relatif rendah dibandingkan logam-logam lain. Misalnya, litium, natrium, dan kalium semuanya lebih ringan daripada air, dan ini menyebabkan mereka bisa mengapung di permukaan air.
Massa jenis yang rendah ini disebabkan oleh struktur atomnya yang longgar, dengan inti atom yang kecil dikelilingi oleh banyak elektron pada jarak yang relatif jauh. Massa jenis semakin meningkat ketika kita bergerak ke bawah golongan, tetapi tetap lebih rendah daripada kebanyakan logam lainnya.
Massa jenis logam alkali sebagai berikut:
- Litium: 0,534 g/cm³
- Natrium: 0,968 g/cm³
- Kalium: 0,862 g/cm³
- Rubidium: 1,532 g/cm³
- Sesium: 1,93 g/cm³
Baca juga: Definisi Usaha dalam Fisika: Pengertian, Rumus, dan Aplikasi
3. Titik Lebur dan Titik Didih Rendah
Logam alkali memiliki titik lebur dan titik didih yang relatif rendah dibandingkan logam lainnya. Ini berarti bahwa mereka mudah melebur bahkan pada suhu yang tidak terlalu tinggi. Misalnya, cesium dapat meleleh pada suhu 28,5°C, hampir mendekati suhu kamar.
Fenomena ini berkaitan dengan ikatan logam yang relatif lemah dalam struktur kristal logam alkali. Dengan hanya satu elektron valensi, gaya tarik antara inti atom dan elektron tidak terlalu kuat, sehingga membutuhkan lebih sedikit energi untuk memutuskan ikatan tersebut.
Berikut adalah data titik lebur dari beberapa logam alkali:
- Litium: 180,5°C
- Natrium: 97,8°C
- Kalium: 63,5°C
- Rubidium: 39,3°C
- Sesium: 28,5°C
4. Konduktivitas Listrik dan Panas yang Tinggi
Logam alkali adalah konduktor listrik dan panas yang sangat baik. Hal ini dikarenakan elektron valensi yang longgar dan mudah bergerak ketika diberikan energi, seperti dalam bentuk panas atau arus listrik.
Elektron valensi ini dapat berpindah dengan cepat ke seluruh struktur logam, sehingga memungkinkan pengaliran listrik dengan sedikit hambatan. Hal ini menjadikan logam alkali bahan yang baik untuk aplikasi yang memerlukan konduktivitas listrik yang tinggi.
Namun, konduktivitas mereka cenderung menurun seiring bertambahnya nomor atom di golongan tersebut. Misalnya, litium dan natrium memiliki konduktivitas listrik yang lebih tinggi dibandingkan cesium, karena semakin besar ukuran atom, semakin sulit bagi elektron untuk bergerak bebas dalam kisi kristal logam.
Baca juga: Contoh Soal Hukum Newton 1: Panduan Lengkap untuk Pemula
5. Sifat Lunak dan Dapat Dibentuk
Logam alkali memiliki sifat yang sangat lunak, sehingga mereka dapat dipotong dengan mudah menggunakan pisau biasa. Kelembutan ini adalah hasil dari gaya ikatan logam yang lemah antara atom-atomnya.
Sebagai perbandingan, litium, natrium, dan kalium sangat lunak sehingga bisa dipotong seperti mentega. Sifat ini memungkinkan logam alkali untuk digunakan dalam aplikasi yang memerlukan logam yang mudah dibentuk.
Kelembutan logam alkali juga berarti mereka tidak terlalu tahan terhadap tekanan atau deformasi, sehingga biasanya tidak digunakan dalam aplikasi struktural. Namun, mereka memiliki peran penting dalam berbagai teknologi modern, seperti baterai dan reaksi kimia tertentu.
6. Reaktivitas Tinggi dengan Air
Salah satu sifat fisika logam alkali yang paling dikenal adalah reaktivitas mereka yang sangat tinggi, terutama ketika bereaksi dengan air.
Ketika logam alkali dimasukkan ke dalam air, mereka dengan cepat melepaskan elektron dan bereaksi dengan molekul air untuk menghasilkan gas hidrogen dan basa kuat, seperti natrium hidroksida (NaOH) atau kalium hidroksida (KOH).
Reaksi ini bersifat eksotermis, yang berarti menghasilkan panas. Dalam beberapa kasus, reaksi ini bisa sangat eksplosif, terutama dengan logam alkali yang lebih berat seperti rubidium atau cesium.
Persamaan kimia dasar reaksi logam alkali dengan air dapat dituliskan sebagai berikut:
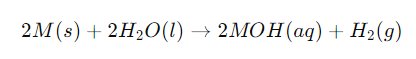
Di mana M adalah simbol logam alkali.
Baca juga: Campuran Homogen Memiliki Komposisi Zat yang Seragam
7. Warna Nyala Api
Logam alkali juga memiliki sifat fisika yang menarik ketika dibakar, yaitu kemampuannya menghasilkan nyala api berwarna khas. Ketika logam alkali dipanaskan, elektron-elektron dalam atom akan tereksitasi ke tingkat energi yang lebih tinggi.
Ketika elektron-elektron ini kembali ke tingkat energi yang lebih rendah, mereka memancarkan energi dalam bentuk cahaya dengan panjang gelombang tertentu, yang menghasilkan warna nyala api khas.
Berikut adalah warna nyala api yang dihasilkan oleh beberapa logam alkali:
- Litium: merah cerah
- Natrium: kuning
- Kalium: ungu
- Rubidium: merah kebiruan
- Sesium: biru
Sifat ini sering digunakan dalam analisis kimia melalui metode spektroskopi nyala untuk mengidentifikasi keberadaan logam alkali dalam suatu sampel.
8. Sifat Magnetik
Secara umum, logam alkali tidak memiliki sifat magnetik yang signifikan karena tidak memiliki elektron tidak berpasangan yang dapat menyebabkan momen magnetik.
Namun, dalam keadaan tertentu, seperti pada suhu sangat rendah atau dalam kondisi medan magnet yang sangat kuat, beberapa logam alkali dapat menunjukkan sedikit efek magnetik. Ini terkait dengan interaksi antara elektron-elektron yang longgar dan medan magnet eksternal.
9. Aplikasi Logam Alkali
Meskipun logam alkali sangat reaktif dan memiliki titik lebur yang rendah, mereka memiliki banyak aplikasi penting dalam berbagai bidang teknologi.
Misalnya, litium dan natrium banyak digunakan dalam baterai karena kapasitasnya untuk menyimpan energi melalui reaksi redoks. Baterai litium-ion, misalnya, merupakan salah satu teknologi penyimpanan energi paling efisien yang banyak digunakan dalam perangkat elektronik seperti ponsel dan laptop.
Selain itu, natrium dan kalium digunakan dalam reaksi kimia industri, seperti dalam pembuatan sabun (proses saponifikasi) dan dalam produksi kaca.
Baca juga: Deposisi Adalah: Proses Penting dalam Fisika dan Aplikasinya dalam Kehidupan
Logam alkali memiliki sifat fisika yang unik dan menarik, mulai dari massa jenis yang rendah, konduktivitas tinggi, hingga reaktivitas yang sangat besar. Sifat-sifat ini memberikan mereka peran yang signifikan dalam berbagai aplikasi, baik dalam sains maupun industri.
Memahami sifat-sifat fisika logam alkali adalah kunci dalam memahami perilaku materi dan aplikasi praktisnya dalam kehidupan sehari-hari, terutama bagi mereka yang belajar fisika.
Sifat-sifat seperti kelembutan, konduktivitas, dan reaktivitas membuat logam alkali menjadi salah satu kelompok elemen yang paling menarik untuk dipelajari dalam fisika modern.