Pada artikel ini berisi Contoh Soal Kimia mengenai Contoh Soal Molaritas Kimia dengan Pembahasan dengan penjelasan yang mudah dan benar
tugassains.com – Ketika kita melakukan perhitungan Konsentrasi Larutan Kimia kita akan menemui pengukuran Molaritas dan Molalitas, meskipun namanya hampir sama tetapi sebenarnya keduanya berbeda dalam pengukuran Konsentrasi Larutan.
Molaritas sering digunakan ketika melakukan praktikum di Laboratorium untuk mengetahui konsentrasi larutan tersebut sebelum digunakan dan Molaritas juga di gunakan dalam Mengencerkan Larutan Kimia.
Baca Juga Rumus Pengenceran dan Cara Mengencerkan Larutan
Pengertian Molaritas (M)
Molaritas adalah pengukuran Konsentrasi Larutan Kimia berdasarkan besar mol yang terlarut terhadap volume Larutan (Liter) sehingga molaritas dapat kita definisikan konsentrasi larutan mol/Liter.
Molaritas dilambangkan dengan M besar berbeda dengan Molalitas yang dilambangkan dengan m kecil
Molaritas memiliki satuan Molar dengan dilambangkan huruf M kapital, sehingga ketika melakukan pengukuran Molaritas kita akan mengetahui dengan adanya huruf M dalam satuannya.
Molaritas = M = mol/Liter
Molalitas = m
Rumus Molaritas (M)
Untuk menghitung besar Molaritas dari suatu Larutan kita hanya membutuhkan besar mol dari zat terlarut dan Volume pelarut dan dapat kita hitung dengan rumus berikut:

Keterangan:
n = merupakan besar mol dari larutan (massa/Mr)
gram = merupakan massa pelarut (gr)
Mr = merupakan Massa Relatif darI unsur
Volume = Volume zat pelarut (Liter)
Setelah mengetahui Rumus Molaritas mari kita pelajari dengan membaca dan melatih diri pada Contoh Soal Molaritas
Contoh Soal Molaritas dengan Pembahasan
Karena kita sudah tahu rumus molaritas kimia mari kita coba dengan beberapa contoh soal berikut:
1. Tentukan Molaritas dari pelarutan NaOH sebanyak 4 mol ke dalam 2000 mL air akuades!
Jawab:
diketahui:
n = 4 mol
V = 2000mL (ubah ke dalam satuan Liter)
V = 2 L
ditanya: Besar Molaritas NaOH?
Penyelesaian:
Untuk menyelasaikannya karena kita sudah tahu besar mol dan volume pelarut kita dapat menghitung molaritas dengan membagi mol terhadap volume pelarut yaitu:

Jadi besar Molaritas dari NaOH yang dilarutkan sebesar 2 mol/Liter atau 2 M.
2. Diketahui sebuah Molaritas dari Larutan NaCl sebesar 0,4 M pada air sebanyak 40 L tentukan banyak mol NaCl yang terlarut pada Air tersebut.
Jawab:
diketahui:
Molaritas = 0,4 M
V = 40 L
ditanya: Besar mol NaCl?
Penyelesaian:
Untuk menyelesaikannya kita hanya perlu mensubtitusikan Molaritas dan Volume ke dalam rumus untuk mencari besar mol.

Jadi besar mol NaCl yang terlarut pada larutan tersebut sebesar 16 mol.
3. Jika sebuah larutan H2SO4 memiliki Molaritas sebesar 0,2 M dan banyak zat H2SO4 yang terlarut sebesar 0,3 mol, tetntukan berapa banyak volume pelarut pada larutan tersebut?
Jawab:
diketahui:
Molaritas = 0,2 M
n = 0,3 mol
ditanya: Banyak pelarut (V)?
Penyelesaian:
Untuk mengetahui banyak pelarut atau air yang digunakan kita dapat menghitung dengan membagikan molaritas dengan banyak mol H2SO4.

Jadi banyak pelarut yang digunakan sebanyak 0,15 L atau 150 mL.
4. Sebanyak 171 gram Al2(SO4)3 dilarutkan pada 500 mL air untuk digunakan dalam praktikum laboratorium, tentukan besar Molaritas dari Larutan Al2(SO4)3 tersebut!
(Ar Al = 27, Ar S = 32, Ar O = 16)
Jawab:
diketahui:
m Al2(SO4)3 = 171 gram
V = 500mL = 0,5
Ar Al = 27, Ar S = 32, Ar O = 16
ditanya: Besar Molaritas dari Al2(SO4)3 yang terlarut?
Penyelesaian:
Untuk menyelesaikan soal seperti ini cari terlebih dahulu besar Mr:
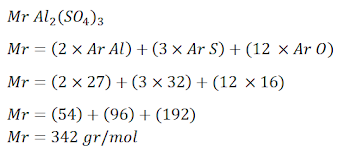
Setelah mengetahui Mr dari Al2(SO4)3 selanjutnya kita dapat menghitung besar molaritas.

Jadi besar Molaritas dari Larutan Al2(SO4)3 sebesar 1 mol/Liter atau 1 M.
Baca Juga Contoh Soal Pengenceran Larutan Kimia Beserta Pembahasannya
Sekian terima kasih semoga bermanfaat dan jangan lupa bagikan.

